
科目: 来源: 题型:解答题
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| B | C |
| D |
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | A、D、E均可形成两种常见氧化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 单质的氧化性减弱 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
科目: 来源: 题型:解答题
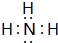 .e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为
.e3z与盐酸反应生成2种盐,其中热稳定性最差的生成盐的电子式为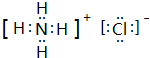 .
. .z单质的电子式为
.z单质的电子式为 ,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为
,其结构式为N≡N.e和d形成原子个数为1:1的化合物的电子式为 .用电子式表示x和d原子个数为1:1的化合物的形成过程
.用电子式表示x和d原子个数为1:1的化合物的形成过程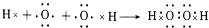 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
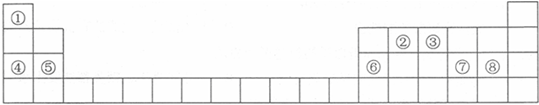
| A. | ①④⑥⑦⑧ | B. | ②③⑤⑧⑩ | C. | ①③④⑥⑨ | D. | ②⑤⑦⑨⑩ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ②③⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
 、⑨
、⑨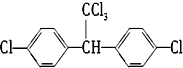 、⑩
、⑩
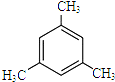 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com