
科目: 来源: 题型:选择题
| A. | n+3 | B. | n+4 | C. | n-6 | D. | n-8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在化学键的断裂过程中,肯定发生了化学反应 | |
| B. | 发生能量变化的一定是化学反应 | |
| C. | 离子化合物中一定含有离子键,共价化合物中一定不含离子键 | |
| D. | 在化学键的断裂过程中,肯定放出能量 |
查看答案和解析>>
科目: 来源: 题型:填空题
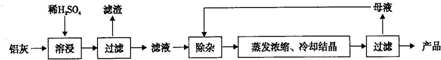
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 操作 | 现象 |
通入氯气至过量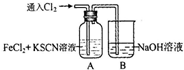 | Ⅰ、A中溶液变红 Ⅱ、稍后,溶液由红色变为黄色 |
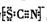 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升温 | B. | 加压 | C. | 减压 | D. | 降温 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤⑥ | C. | ②④⑥ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:解答题
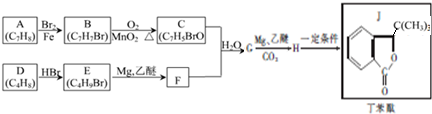
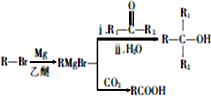
 .
.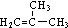 +HBr→(CH3)3CBr.
+HBr→(CH3)3CBr.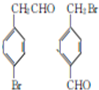 .
.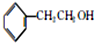 )
) .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Y>X,离子半径:Z<W | |
| B. | 元素Y的单质能与元素X的最高价氧化物发生置换反应 | |
| C. | 元素Y和W能形成YW2型共价化合物 | |
| D. | W的单质有毒,且有漂白性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 离子组 | 试剂 | 发生反应的离子方程式 |
| A | K+、AlO2-、NO3- | 过量CO2 | CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- |
| B | Fe3+、I-、ClO- | 少量NaOH溶液 | Fe3++3OH-=Fe(OH) 3↓ |
| C | Ca2+、Na+、OH- | 少量NaHCO3溶液 | HCO3-+OH-=CO32-+H2O |
| D | NH4+、HCO3-、Cl- | 少量NaOH溶液 | NH4++OH-=NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com