
科目: 来源: 题型:解答题
| X | |
| Y | Z |
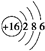 ,U2X的电子式
,U2X的电子式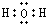
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在容器中共存 | ||
| C. | P、Q的反应速率相等内部 | D. | P、Q、R、S的浓度不再变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ②③⑤⑥ | C. | ②⑤⑥ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
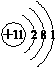 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝的第一电离能比镁的第一电离能大 | |
| B. | 钾的第一电离能比镁的第一电离能大 | |
| C. | 在所有的元素中,F的第一电离能最大 | |
| D. | 第3周期所含元素中钠的第一电离能最小 |
查看答案和解析>>
科目: 来源: 题型:解答题
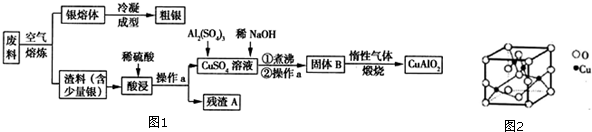
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com