
科目: 来源: 题型:解答题
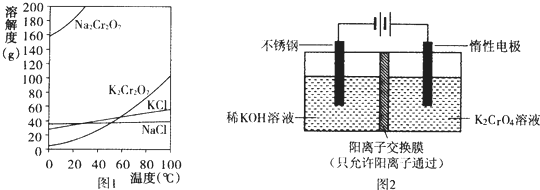
查看答案和解析>>
科目: 来源: 题型:解答题
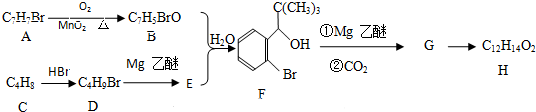
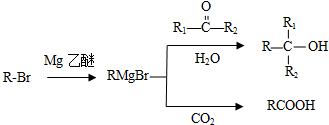
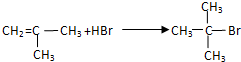 ;G→H
;G→H .
.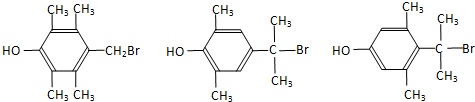 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60s时X的平均反应速率为0.02mol/L | |
| B. | 将容器容积变为20L,Z的新平衡浓度将等于原平衡浓度的$\frac{1}{2}$ | |
| C. | 若温度和体积不变,往容器内增加1molX,Y的转化率将增大 | |
| D. | 若升高温度,X的体积分数增大,则正反应的△H>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
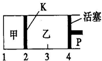 一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
一定温度下可逆反应A(s)+2B(g)?2C(g)+D(g)△H<0.现将1molA和2molB加入甲容器中,将4molC和2molD加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )| A. | 保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持温度和乙中的压强不变,分别向甲、乙中加入等质量的氦气后,甲中平衡不移动,乙中平衡向正反应方向移动 | |
| C. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小 | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2无毒,对大气不造成污染,所以可以无限量排放 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | Na2CO3溶液可与Ba(OH)2溶液反应,NaHCO3溶液不与Ba(OH)2溶液反应 | |
| D. | NaHCO3溶液与NaOH溶液混合会发生反应,但观察不到明显的现象 |
查看答案和解析>>
科目: 来源: 题型:填空题
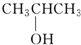 ⑨${\;}_{6}^{13}$C (填序号)
⑨${\;}_{6}^{13}$C (填序号)查看答案和解析>>
科目: 来源: 题型:解答题
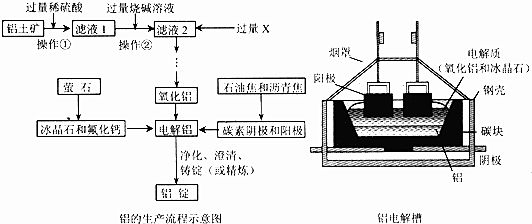
查看答案和解析>>
科目: 来源: 题型:选择题
 利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | b点时,CO的转化率为20% | |
| B. | 容器内的压强保持恒定,表明反应达到平衡状态 | |
| C. | b点和d点的化学平衡常数:Kb>Kd | |
| D. | 0到0.5min反应速率V(CO)=0.3mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
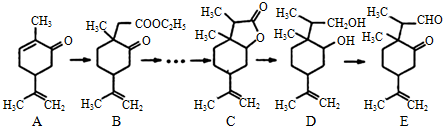
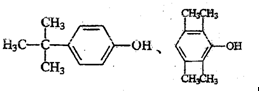 .
.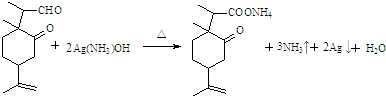 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸工业中,三氧化硫在吸收塔内被水吸收制成浓硫酸 | |
| B. | 炼铁工业中,用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁 | |
| C. | 合成氨工业中,用铁触媒作催化剂,可提高单位时间氨的产量 | |
| D. | 氯碱工业中,电解槽的阴极区产生NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com