
科目: 来源: 题型:选择题
| A. | 按系统命名法,化合物 的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 | |
| D. | 某有机物的结构简式为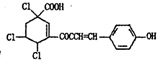 ,1mol该有机物通过消去反应脱去1 molHCl时,能得到5种不间产物(不考虑立体异构) ,1mol该有机物通过消去反应脱去1 molHCl时,能得到5种不间产物(不考虑立体异构) |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | H2、I2和HI分子中的化学键都是非极性共价键 | |
| B. | 断开2mol HI分子中的化学键所需能量约为(c+b+a)kJ | |
| C. | 相同条件下,1mol H2(g)和1mol I2(g)总能量小于2molHI(g)的总能量 | |
| D. | 向密闭容器中加入2mol H2(g)和2mol I2(g),充分反应后放出的热量小于2a kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 为测定熔融氢氧化钠的导电性,可将氫氧化钠固体放在石英坩埚中加热熔化 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计箅机芯片的材料是经提纯的二氧化硅 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=0.5mol/(L•s) | ||
| C. | v(C)=0.62mol/(L•s) | D. | v(B2)=4.2mol/(L•min) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油的催化重整和煤的干馏均可以得到芳香烃,说明石油和煤中含有芳香烃 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏得到的产物可用来萃取溴水中的溴 | |
| D. | 石油裂化主要得到的是乙烯、丙烯等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe(OH)3 Fe2O3 | B. | Fe(OH)2 Fe2O3 | C. | Fe(OH)2 Fe(OH)3 | D. | Fe(OH)2 Fe3O4 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题


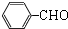 .
.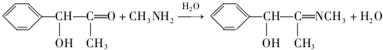 .
. .
.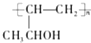 的合成路线,其它试剂及溶剂任选.
的合成路线,其它试剂及溶剂任选.查看答案和解析>>
科目: 来源: 题型:解答题

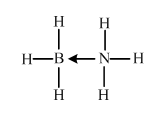 (必须标明配位犍).
(必须标明配位犍).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com