
科目: 来源: 题型:多选题
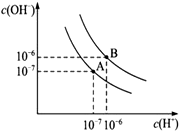
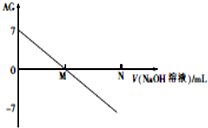 为了更好地表示溶液的酸碱性,科学家提出了酸度(aciditygrade)的概念,定义AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1 醋酸,滴定结果如图所示,下列有关叙述不正确的是( )
为了更好地表示溶液的酸碱性,科学家提出了酸度(aciditygrade)的概念,定义AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,室温下用0.01mol•L-1的氢氧化钠溶液滴定20.00mL0.01mol•L-1 醋酸,滴定结果如图所示,下列有关叙述不正确的是( )| A. | 室温下,醋酸的电离平衡常数约为10-6 | |
| B. | M点加入NaOH溶液的体积大于20.00mL | |
| C. | M点时溶液中:c(CH3COO-)=c(Na+) | |
| D. | 若N点时加入NaOH溶液的体积为40mL,则N点时溶液中:c(Na+)=2[c(CH3COO-)+c(CH3COOH)] |
查看答案和解析>>
科目: 来源: 题型:选择题
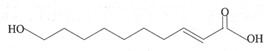 王浆酸是从蜂王浆中分离出的一种有机酸,它有很好的杀菌、抗癌、抗放射及强化机体、增强免疫力的作用,其结构如图所示,有关王浆酸的说法不正确的是( )
王浆酸是从蜂王浆中分离出的一种有机酸,它有很好的杀菌、抗癌、抗放射及强化机体、增强免疫力的作用,其结构如图所示,有关王浆酸的说法不正确的是( )| A. | 分子式为C10H18O3 | |
| B. | 能使溴的四氯化碳溶液褪色 | |
| C. | 一定条件下能发生取代反应和氧化反应 | |
| D. | 1mol王浆酸最多能中和2molNaOH |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
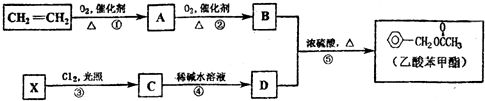
 ,④的反应类型是取代反应.
,④的反应类型是取代反应.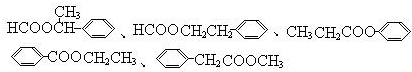 任意一种.
任意一种. .
.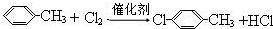 .
.查看答案和解析>>
科目: 来源: 题型:多选题
 常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )
常温下用0.1000mol•L-1盐酸滴定25mL 0.1000mol•L-1Na2CO3(aq),溶液的pH与加入盐酸体积的关系如图.在滴定过程中所得溶液里相关微粒的浓度关系正确的是( )| A. | a点:c(CO32-)>c(HCO3-)>c(Cl-) | B. | b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) | ||
| C. | c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | D. | d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
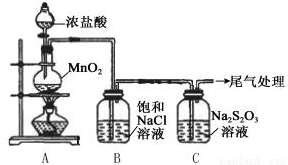
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:解答题
 制备
制备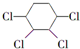
 B:
B: .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O
+2NaCl+2H2O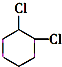 的含有六元碳环的同分异构体:
的含有六元碳环的同分异构体: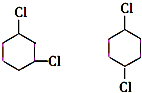
查看答案和解析>>
科目: 来源: 题型:解答题
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
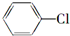
科目: 来源: 题型:解答题
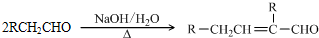
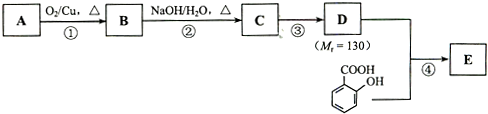
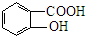 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:选择题
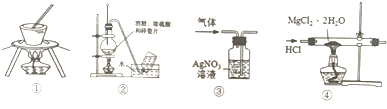
| A. | 用图①装置蒸发饱和食盐水制取食盐晶体 | |
| B. | 利用装置②制备并收集乙烯 | |
| C. | 用装置③除去氯气中少量氯化氢 | |
| D. | 用装置④制取无水MgCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com