
科目: 来源: 题型:解答题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 试管1 | 17.5 | 34.9 | 50.1 | 60.3 | 70.4 | 80.2 | 84.9 | 85.2 | 85.4 |
| 试管2 | 21.7 | 41.2 | 57.5 | 70.8 | 81.3 | 84.9 | 85.3 | 85.4 | 85.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
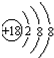 ;
;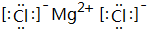 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
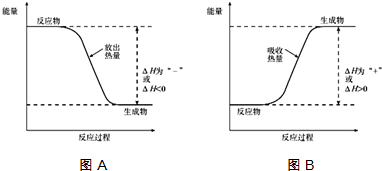
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | W的最高价氧化物对应的水化物难溶于水 | |
| B. | 原子半径按X、Y、Z、R、W的顺序依次增大 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | WY2能与强碱溶液反应,但不能与任何酸反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C | B. | CO | C. | CH4 | D. | C2H5OH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y元素位于第二周期第ⅦA族或0族 | |
| B. | X、Y、Z三种元素中非金属性最强的是X元素 | |
| C. | Y的最高氧化物对应的水化物是已知酸中最强的酸 | |
| D. | Z分别与X、Y形成的化合物都是离子化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 俄国化学家门捷列夫编制了第一张元素周期表 | |
| B. | 周期表中最外层电子数相同的元素都排列在同一列中 | |
| C. | 周期表中一共有18列,但只有16个族 | |
| D. | 随着人们的认识的发展,周期表也在不断的发展变化着 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化合物沸点:HI>HBr>HCl>HF | B. | 离子还原性:I->Br->Cl->F- | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 粒子半径:Al3+<Mg2+<F- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增加某一反应物的用量一定能够加快该反应的速率 | |
| B. | 化学反应的限度是不可改变的 | |
| C. | 化学反应进行的时间越长该反应的限度越大 | |
| D. | 化学反应达到限度时,正逆反应速率相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 随着电子层数的增加单质的密度逐渐升高 | |
| B. | 随着核电荷数的增加单质的熔点逐渐降低 | |
| C. | 在自然界中都只能以化合态形式存在 | |
| D. | 单质都能与水反应,且反应后的溶液都呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com