
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
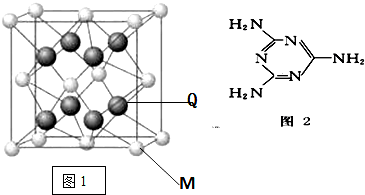
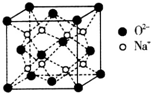 H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题: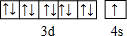 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A与C原子的基态电子排布中L能层都有两个未成对电子,C、D同主族. E、F都是第四周期元素,E原子的基态电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1.
,F原子的电子排布式是1s22s22p63s23p63d104s1. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.查看答案和解析>>
科目: 来源: 题型:解答题
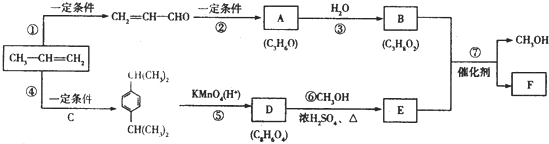
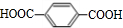 ;F的结构简式为
;F的结构简式为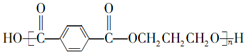 .
.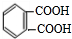 .
.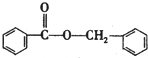 )的合成路线
)的合成路线 .
.查看答案和解析>>
科目: 来源: 题型:解答题
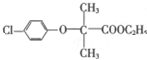 ).
).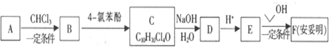
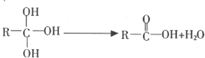 ;
;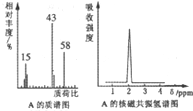
 .
. 与O2反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
与O2反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.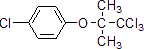 .
.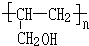 .
.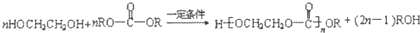
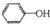 生成中间体N,N与
生成中间体N,N与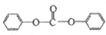 合成工程塑料M(
合成工程塑料M(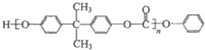 ),则由N合成M的聚合反应方程式为n
),则由N合成M的聚合反应方程式为n +n
+n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(2n-1)
+(2n-1) .
.查看答案和解析>>
科目: 来源: 题型:解答题
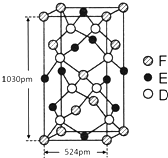
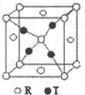 X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题:
X、Y、Z、R、T为周期表前四周期的元素,原子序数依次增大.X元素的一种核素无中子存在,Y的2p能级中有1个空轨道,Z的单质为空气的主要成分,R的最外层电子数为其内层电子数的3倍,T原子的价层电排布式是3d74s2.回答下列问题: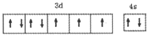 .
.| 电负性 | 原子半径 | 沸点 | 酸性 |
| Y<Z | Z>R | Y2X6<YX4R | XZR3>XZR2 |
查看答案和解析>>
科目: 来源: 题型:选择题
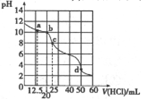 室温下,用0.1000mol/L盐酸滴定25mL0.1000mol/LNa2A溶液(已知H2A为二元弱酸),其滴定曲线如图所示,下列对滴定中所得溶液的相关离子浓度关系判断正确的是( )
室温下,用0.1000mol/L盐酸滴定25mL0.1000mol/LNa2A溶液(已知H2A为二元弱酸),其滴定曲线如图所示,下列对滴定中所得溶液的相关离子浓度关系判断正确的是( )| A. | a点:c(A2-)=c(HA-) | B. | b点:5c(Cl-)=4[c(A2-)+c(HA-)+c(H2A)] | ||
| C. | c点:c(Na+)>c(HA-)>c(A2-)>c(H2A) | D. | d点:c(H+)=c(HA-)+c(A2-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4LN2中含有π健数为3NA | |
| B. | 12g金刚石中含有C-C键数为4NA | |
| C. | 25℃时,pH=12的CH3COONa溶液中水电离出的OH-的数目为0.01NA | |
| D. | 当反应3(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$4NH3↑+3SO2↑+N2↑+6H2O生成89.6L标准状况的气体时,转移的电子数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
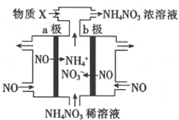 电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )| A. | a极接电源的负极 | |
| B. | 阳极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+=NH4++H2O | |
| D. | X为NH3最终制得3molNH4NO3理论上需补充2molX物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com