
科目: 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>d>c>a |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 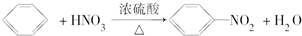 | |
| C. | CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOC2H5+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷与氯气混合后在光照的条件下发生反应 | |
| B. | 甲苯与Br2发生反应 | |
| C. | 乙炔与氢气的加成反应 | |
| D. | 乙烯与氯化氢的加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
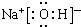 .
.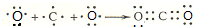
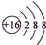 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | X元素不能形成氧化物 | |
| B. | Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | |
| C. | X元素的非金属性比Y元素非金属性强 | |
| D. | 四种元素中,原子半径最小的元素是Y |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子半径:Cl->F->Na+>Al3+ | B. | 原子半径:Na>P>O>F | ||
| C. | 热稳定性:PH3>H2S>HCl>HF | D. | 金属性:Rb>K>Mg>Al |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 22.4L O2的分子数约为NA | |
| B. | 标准状况下,11.2L H2O的分子数约为0.5NA | |
| C. | 1 L 1mol/L的NaOH溶液中Na+的数目为NA | |
| D. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com