
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s | |
| 1 | 0.10 | 丝 | 0.7 | 20 | 250 | |
| 2 | 0.10 | 丝 | 1.0 | 20 | 200 | |
| 3 | 0.10 | 粉末 | 1.0 | 20 | 125 | |
| 4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
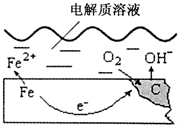 如图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2.Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.请根据图示,回答下列问题:
如图是钢铁在潮湿空气里发生电化学腐蚀的示意图,发生的反应为:2Fe+2H2O+O2═2Fe(OH)2.Fe(OH)2继续被氧化为Fe(OH)3,Fe(OH)3脱水生成铁锈.请根据图示,回答下列问题:| 物质 | 熔点/°C | 沸点/°C | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目: 来源: 题型:多选题
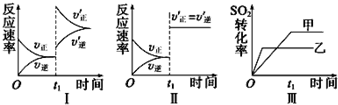
| A. | 图Ⅰ研究的是t1时刻,升高了反应的温度 | |
| B. | 图Ⅱ研究的是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ若是研究不同压强对平衡的影响,且乙反应的压强较高 | |
| D. | 图Ⅲ若是研究不同温度对平衡的影响,且乙的反应温度较高 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | C物质的物质的量浓度不变 | B. | 物质C和物质D的物质的量浓度相等 | ||
| C. | B物质的转化率不发生变化 | D. | 反应速率v (A)=v (D) |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 将收集NO2气体的烧瓶密闭后,放在装有热水的烧杯中,发生颜色变化 | |
| C. | 合成氨时采用铁触媒作反应催化剂 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 3 v (N2)=v(H2) | B. | v (N2)=3v(H2) | C. | 1.5v (H2)=v(NH3) | D. | v (N2)=2v(NH3) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 钢铁发生电化学腐蚀时,负极反应都是Fe-3e-=Fe3+ | |
| B. | 镀锡的铁制品,若发生镀层破损,铁制品比受损前更容易锈蚀 | |
| C. | 铜的金属活动性比铁弱,可在海轮外壳上装上铜块以减缓船体腐蚀 | |
| D. | 钢铁发生吸氧腐蚀时,正极反应是:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | v(A)=0.15 mol•(L•s)-1 | B. | v(B)=0.6 mol•(L•s)-1 | ||
| C. | v(C)=0.6 mol•(L•s)-1 | D. | v(D)=0.2 mol•(L•s)-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com