
科目: 来源: 题型:解答题
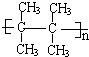 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ⑤⑥ | C. | ③④ | D. | ⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:解答题
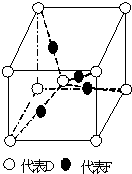
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
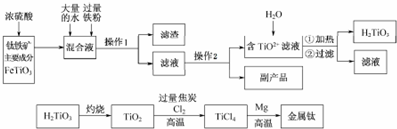
查看答案和解析>>
科目: 来源: 题型:解答题
 现有A、X、Y、Z、W五种元素,它们的原子序数依次增大.A原子的核外总数与其周期数相同;X基态原子的L电子层中有3个未成对电子;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;Z基态原子的3p轨道上得到两个电子后不能再容纳外来电子;W基态原子的最外层电子数为1,其余各电子层均充电子层均充满电子.请回答下列问题:
现有A、X、Y、Z、W五种元素,它们的原子序数依次增大.A原子的核外总数与其周期数相同;X基态原子的L电子层中有3个未成对电子;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;Z基态原子的3p轨道上得到两个电子后不能再容纳外来电子;W基态原子的最外层电子数为1,其余各电子层均充电子层均充满电子.请回答下列问题: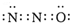 ,其中心原子的杂化轨道类型是sp,1molX2Y含有的π键数目为2NA.
,其中心原子的杂化轨道类型是sp,1molX2Y含有的π键数目为2NA.查看答案和解析>>
科目: 来源: 题型:解答题
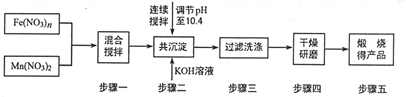 随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:(提示:锰元素在本题所有过程中价态均不变).
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:(提示:锰元素在本题所有过程中价态均不变).查看答案和解析>>
科目: 来源: 题型:解答题
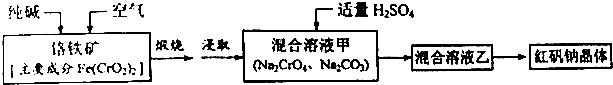
查看答案和解析>>
科目: 来源: 题型:解答题
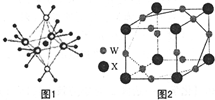
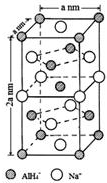 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
. (标明配位键).
(标明配位键).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com