
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学平衡是一个动态平衡 | |
| B. | 化学平衡研究的对象主要是可逆反应 | |
| C. | 化学反应速率是研究化学反应进行的快慢问题,化学平衡是研究化学反应进行的限度问题 | |
| D. | 化学反应达到平衡时,正反应和逆反应速率相等,是对反应中不同物质而言 |
查看答案和解析>>
科目: 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
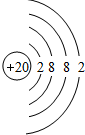 .
.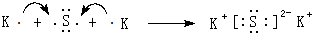 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4 | B. | CrO3 | C. | Cr2(SO4)3 | D. | CH3CH2OH |
查看答案和解析>>
科目: 来源: 题型:解答题
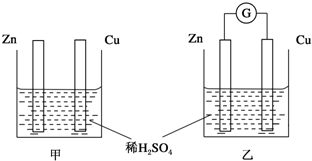
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属性:Y>Z | B. | 氢化物的稳定性:X>W | ||
| C. | 离子的还原性:X>W | D. | 离子半径:Z>Y>X |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 第二周期中形成化合物最最多的元素 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期中可以作为半导体材料的元素 |
| E | 第四周期中最外层只有一个电子且内层完全排满电子的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com