
科目: 来源: 题型:选择题
| A. | 0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+] | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 向氨水中逐滴加入盐酸至溶液的pH=7,则混合液中:[NH4+]=[Cl-] | |
| D. | pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化碳和漂白粉作用,生成具有氧化性的物质 | |
| B. | 二氧化硫通入氢硫酸中,使溶液的酸性一定减弱 | |
| C. | 二氧化硫和烧碱反应,使溶液的碱性一定减弱 | |
| D. | 二氧化氮可相互结合为四氧化二氦氮 |
查看答案和解析>>
科目: 来源: 题型:实验题
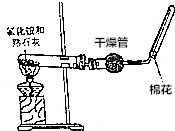 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).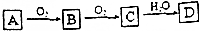
查看答案和解析>>
科目: 来源: 题型:解答题
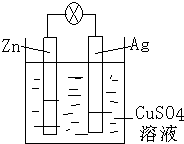 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液,回答下列问题:
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液,回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 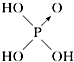 | 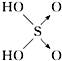 | 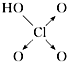 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 ,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O;
,H3PO3与过量的NaOH溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O; ,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.
,在H3AsO3中加入浓盐酸,反应的化学方程式为As(OH)3+3HCl=AsCl3+3H3O.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/mol.L-1 | v(H2SO4)/mL | 溶液温度反应前/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HAt很稳定 | B. | 砹易溶于某些有机溶剂 | ||
| C. | AgAt不溶于水 | D. | 砹是有色固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com