
科目: 来源: 题型:选择题
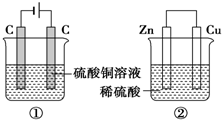 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
查看答案和解析>>
科目: 来源: 题型:解答题
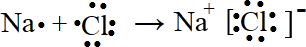 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | υ正=υ逆≠0时的状态 | B. | NO2全部转变成N2O4的状态 | ||
| C. | c(NO2)=c(N2O4)的状态 | D. | 体系的颜色发生变化的状态 |
查看答案和解析>>
科目: 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目: 来源: 题型:填空题
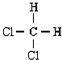 和
和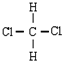
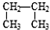 和
和
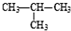
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com