
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.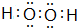 ,用电子式表示Z2M的形成过程:
,用电子式表示Z2M的形成过程: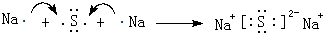 .
.| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | IA族与ⅦA族元素间形成的化合物都是离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子从上到下还原性减弱 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
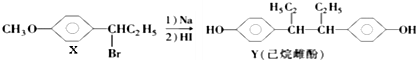
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与Br2发生加成反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验装置 | 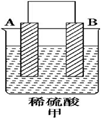 |  | 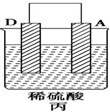 |
| 部分实验现象 | A(二价金属)不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com