
科目: 来源: 题型:解答题
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C2H6 | B. | C2H5OH | C. | C2H4O | D. | C2H4O2 |
查看答案和解析>>
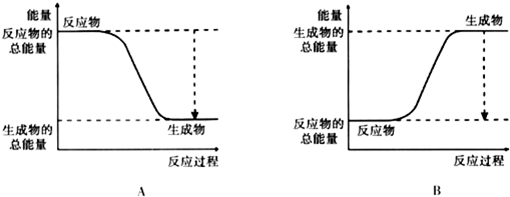
科目: 来源: 题型:解答题
 ,Y中含有的化学键类型是共价键.
,Y中含有的化学键类型是共价键.
查看答案和解析>>
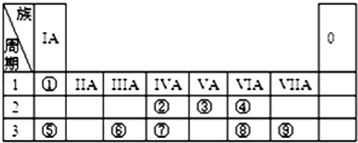
科目: 来源: 题型:选择题
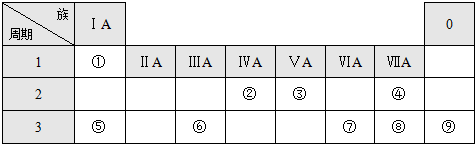
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-1nm) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | 上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤ | |
| B. | ③④处于同一周期 | |
| C. | 元素⑤的氢化物沸点高于元素①的氢化物 | |
| D. | ⑧号元素位于周期表中第三周期第ⅢA族 |
查看答案和解析>>
科目: 来源: 题型:选择题
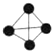 ),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| B. | N4属于一种新型的化合物 | |
| C. | 14N与15N化学性质不相同 | |
| D. | 1mol N4气体完全转变为N2将放出882kJ热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 液态HCl不能导电,属于共价化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
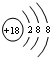 .
.查看答案和解析>>
科目: 来源: 题型:解答题
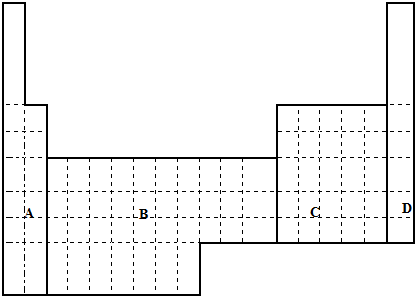
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com