
科目: 来源: 题型:选择题
| A. | 熔点:GeCl4<NaCl | |
| B. | 酸性:Ge(OH)4>Sn(OH)4>Pb(OH)4 | |
| C. | 相同条件下,锗、锡、铅单质分别与稀硫酸反应,速率依次减慢 | |
| D. | 常温下在空气中,锗单质不被氧化,铅单质表面生成一层保护薄膜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢气分子内每个氢原子都达到了8电子稳定结构 | |
| B. | 1molH2的能量比2molH的能量低 | |
| C. | 1molH2离解成2molH要放出437.6kJ的热量 | |
| D. | 氢原子不如氢气分子活泼 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 还原性强弱:CI-<Br一<I - | B. | 微粒半径大小:S>Na+>O2- | ||
| C. | 热稳定性:HF>H2O>NH3 | D. | 碱性:KOH>NaOH>LiOH |
查看答案和解析>>
科目: 来源: 题型:解答题
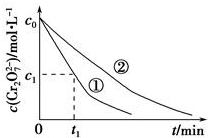 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目: 来源: 题型:解答题
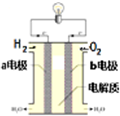 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.查看答案和解析>>
科目: 来源: 题型:选择题
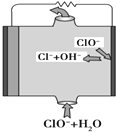 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )| A. | 镁燃料电池中镁均为负极,发生氧化反应 | |
| B. | 镁次氯酸盐燃料电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- | |
| C. | 镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O | |
| D. | 镁次氯酸盐燃料放电过程中OH-移向正极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 周期表中金属与非金属交界处可找到合成催化剂的元素 | |
| B. | 有热量放出的变化一定是放热反应 | |
| C. | 化学反应中能量变化的主要原因是有化学键的断裂与形成 | |
| D. | 影响化学反应速率的本质因素是催化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X元素原子的电子层数比Y元素原子的电子层数多 | |
| B. | X的气态氢化物比Y的气态氢化物稳定 | |
| C. | X的最高价氧化物对应水化物的酸性比Y的弱 | |
| D. | Y的单质能将X从NaX溶液中置换出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com