
科目: 来源: 题型:解答题
 碳、氮在自然界中广泛存在.
碳、氮在自然界中广泛存在.查看答案和解析>>
科目: 来源: 题型:解答题
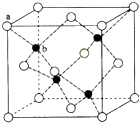 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.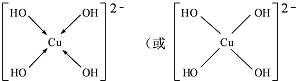 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
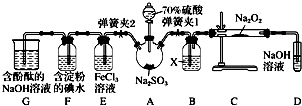
查看答案和解析>>
科目: 来源: 题型:解答题
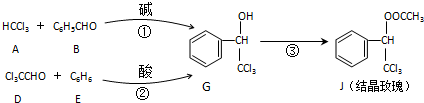

查看答案和解析>>
科目: 来源: 题型:解答题
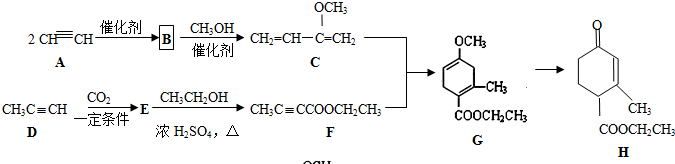
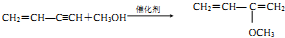 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
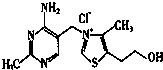 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 氨气在工农业生产中有非常重要的应用.
氨气在工农业生产中有非常重要的应用.查看答案和解析>>
科目: 来源: 题型:解答题
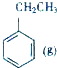 +CO2(g)?
+CO2(g)?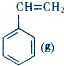 +CO(g)+H2O(g)△H
+CO(g)+H2O(g)△H ?
? +H2(g)△H1=+117.6kJ/mol
+H2(g)△H1=+117.6kJ/mol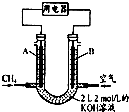
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 甲和乙互为同分异构体,均既能发生氧化反应,又能发生酯化反应 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| D. | 均能与溴水反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C23H48、C25H52、C27H56的碳含量依次减小 | |
| B. | 1molC23H48含共价键70mol | |
| C. | C23H48、C25H52、C27H56互为同系物 | |
| D. | C23H48、C25H52、C27H56均不溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com