
科目: 来源: 题型:选择题
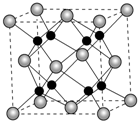
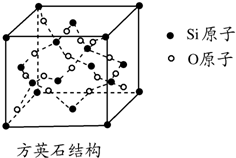 二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )
二氧化硅有晶体和无定形两种形态,晶态二氧化硅主要存在于石英矿中.除石英外,SiO2还有磷石英和方英石等多种变体.方英石结构和金刚石相似,其结构单元如图.下列有关说法正确的是( )| A. | 方英石晶体中存在着SiO4结构单元 | |
| B. | 1 mol Si形成2 mol Si-O键 | |
| C. | 上图所示的结构单元中实际占有18个硅原子 | |
| D. | 方英石晶体中,Si-O键之间的夹角为90° |
查看答案和解析>>
科目: 来源: 题型:选择题
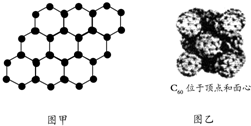
| A. | 60 g SiO2晶体中含有2×6.02×1023个Si-O键 | |
| B. | 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图甲),则0.12 g石墨烯中含有6.02×1022个碳原子 | |
| C. | 720 g C60晶体(如图乙)中含有6.02×1023个晶胞结构单元 | |
| D. | 14 g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:1 | B. | 3:2 | C. | 5:2 | D. | 5:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③④⑥ | C. | ③④⑤⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有的电子在同一区域里运动 | |
| B. | 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 | |
| C. | 处于最低能量的原子叫基态原子 | |
| D. | 同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
查看答案和解析>>
科目: 来源: 题型:解答题
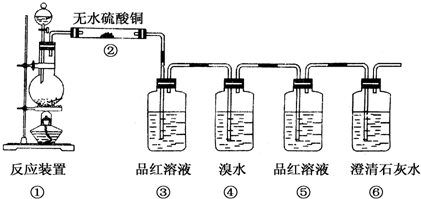
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A-F) |
查看答案和解析>>
科目: 来源: 题型:解答题
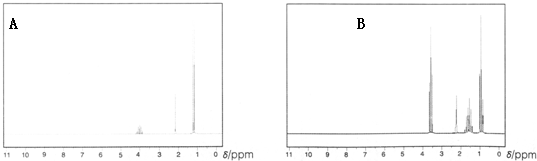
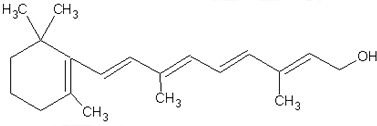
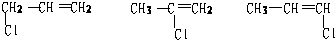 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com