
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | … | |
| R | 740 | 1500 | 7700 | 10500 | 13600 | … |
| A. | ①③ | B. | ②③ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电子云伸展方向与电子的能量大小是无关的 | |
| B. | 只含极性键的分子一定是极性分子 | |
| C. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| D. | H-O键键能为462.8 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×462.8 kJ |
查看答案和解析>>
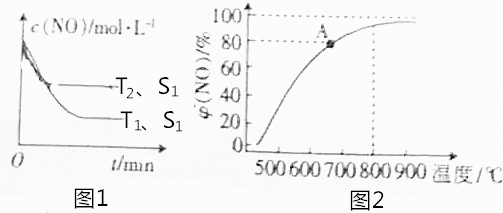
科目: 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(A) | n(B) | n(C) | ||
| ① | 700 | 4.0 | 1.0 | 1.80 |
| ② | 800 | 1.0 | 4.0 | 1.60 |
| ③ | 800 | 2.0 | 2.0 | a |
| ④ | 900 | 1.0 | 1.0 | b |
| A. | 实验①中,若10min达到平衡,则v(D)=9.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=3.2 | |
| C. | 实验③中,达到平衡时A的转化率为60% | |
| D. | 实验④中,达到平衡时,b<1.0 |
查看答案和解析>>
科目: 来源: 题型:实验题
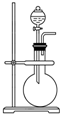 如图是实验室制取某些气体的装置.
如图是实验室制取某些气体的装置.查看答案和解析>>
科目: 来源: 题型:解答题
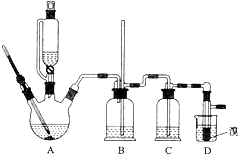
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH2=CH-CH3 | C. | CH2=CH-CH2-CH3 | D. | CH2=C(CH3)2 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
| Ⅰ | 1﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
| Ⅱ | 1﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
| Ⅲ | 1﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
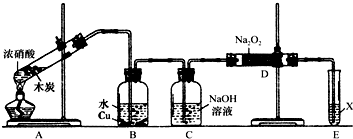
查看答案和解析>>
科目: 来源: 题型:解答题
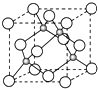 A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C是短周期非金属元素,核电荷数依次增大.A元素原子核外有三种不同的能级且各个能级所填充的电子数相同,C是地壳中含量最多的元素.D、E是第四周期元素,其中E元素的核电荷数为29.D原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com