
科目: 来源: 题型:填空题
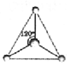 CH3+;
CH3+;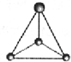 CH3-.
CH3-.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| u | 420 | 3100 | 4400 | 5900 |
| A. | T的氯化物最可能的化学式为TCl3 | |
| B. | 氦元素最有可能与Q元素位于同一族 | |
| C. | 在同周期表中,最可能处于同一族的是R和U | |
| D. | U元素最有可能为K,R元素最有可能为Li |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 晶体硅没有固定的熔沸点 | |
| B. | 形成晶体硅的速率越快越好 | |
| C. | 可用于X-射线衍射实验来鉴别晶体硅和玻璃 | |
| D. | 晶体硅的形成与晶体的自范性有关,形成的晶体无各向异性 |
查看答案和解析>>
科目: 来源: 题型:选择题
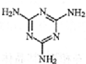 )添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )
)添加于奶粉中,增加奶粉中的含氮量.下列关于三聚氰胺分子的说法正确的是( )| A. | 形成的晶体熔点较高 | |
| B. | 一个分子中共含有15个σ键 | |
| C. | 属于极性分子,故极易溶于水 | |
| D. | 所有面原子采用sp2杂化,所有氮原子采用sp3杂化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熔点由高到低:NaCl>Na-K合金>Na | |
| B. | 晶体的熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| C. | 晶体的硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶体的晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 | |
| B. | 杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 | |
| C. | 若AB2分子的构型为V型,则A可能为sp2杂化 | |
| D. | H2S和SO2分子中的中心原子杂化类型相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| B. | 气体单质中一定有σ键,可能有π键 | |
| C. | 乙烯与氢气发生加成反应时,乙烯分子中有π键断裂 | |
| D. | 当原子形成分子时,首先形成σ键,可能形成π键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 范德华力 | B. | 共价键 | C. | 氢键 | D. | 离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com