
科目: 来源: 题型:选择题
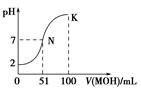 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )| A. | HA为一元强酸 | |
| B. | MOH为一元弱碱 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
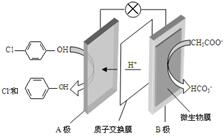 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法正确的是( )| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为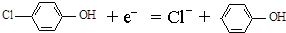 | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.2NA | |
| D. | B极为电池的正极,发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、Y的单质均具有较高的熔沸点 | |
| B. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | Z、W形成的化合物中既含有离子键,又含有共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| B. | 取50mL 18.0mol/L浓硫酸与足量的铜片反应,生成气体分子的数目为0.45NA | |
| C. | 1L 0.1 mol•L-1碳酸钠溶液中,阴离子数目大于0.1NA | |
| D. | 53.5gNH4Cl中存在的共价键总数为5NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
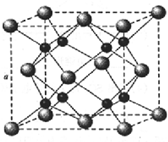 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
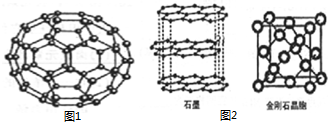 C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.
C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 卤族元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目: 来源: 题型:解答题
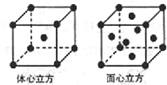 Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:| 元素 | Mn | Fe | |
| 电离能(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com