
科目: 来源: 题型:选择题
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若原料完全反应生成上述产物,CH2CH2Br与NH3的物质之比为2:1 | |
| B. | 该反应属于取代反应 | |
| C. | CH2CH2Br与HBr均属于电解质 | |
| D. | CH2CH2Br难溶于水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,22g CO2含碳氧双键数目为2 NA | |
| B. | 12.0g NaHSO4固体中含阳离子数目为0.1 NA | |
| C. | 标准状况下,22.4 L Br2中所含分子数为NA | |
| D. | 7.8 g Na202与足量的水反应转移电子数为0.2 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
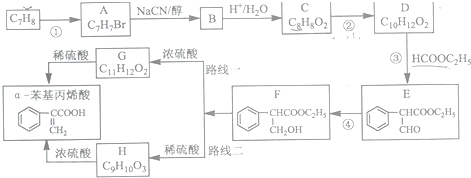


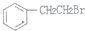 制备
制备 的合成路线.
的合成路线.查看答案和解析>>
科目: 来源: 题型:解答题
 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$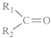 +
+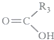
 .
.
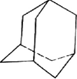 )是月桂烯的一种同分异构体,其一氯代物有2种.
)是月桂烯的一种同分异构体,其一氯代物有2种. .
.查看答案和解析>>
科目: 来源: 题型:解答题
 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:| 实验装置 | 实验现象 |
 | 品红褪色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 ,写出CO2的电子式
,写出CO2的电子式 .
.查看答案和解析>>
科目: 来源: 题型:选择题
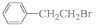 与过量NaOH醇溶液共热时发生了消去反应的是( )
与过量NaOH醇溶液共热时发生了消去反应的是( )| A. | 混合体系$\stackrel{溴水}{→}$Br2的颜色褪去 | |
| B. | 混合体系$\stackrel{足量稀HNO_{3}}{→}$ $\stackrel{AgNO_{3}溶液}{→}$淡黄色沉淀 | |
| C. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{酸性KMnO_{4}溶液}{→}$紫色褪去 | |
| D. | 混合体系$\stackrel{提取}{→}$有机物$\stackrel{Br_{2}的CCl_{4}溶液}{→}$Br2的颜色褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com