
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 操作或装置 |  | 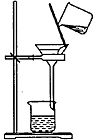 | 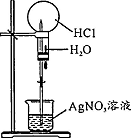 | 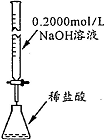 |
| 目的 | 配制一定物质的量浓度溶液 | 分离Na2CO2溶液和CH3COOC2H5的混合物 | 做“白色”喷泉实验 | 用NaOH溶液滴定稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2molNa202和Na2S的混合物中共含有离子数目为0.6NA | |
| B. | 2.24LNz和足量Hz充分反应转移的电子数目为0.6NA | |
| C. | 含氢原子1.806×l024的甲基中含有的质子数为10NA | |
| D. | 1.0L1.0mol/LFeCI3溶液全部转化成氢氧化铁胶体所得胶粒数目为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氯甲烷、二氧化碳都是极性分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯碱主要成分为Na2CO3 | B. | 热的纯碱溶液去污效果更好 | ||
| C. | 纯碱有利于油污水解 | D. | 纯碱常用于治疗胃酸过多 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
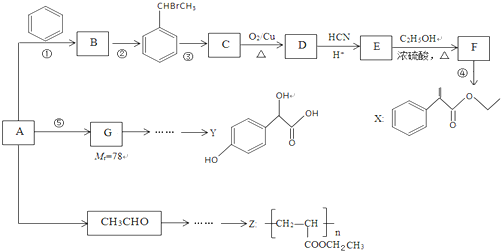
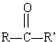 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$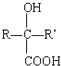 R或R′可以是烃基或氢原子
R或R′可以是烃基或氢原子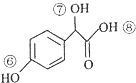 的说法正确的是AD.
的说法正确的是AD. .
.查看答案和解析>>
科目: 来源: 题型:解答题
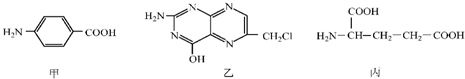
 .
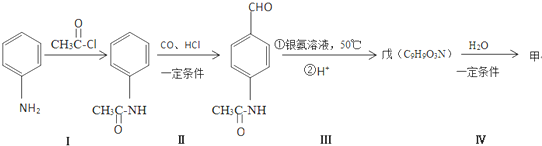
.
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
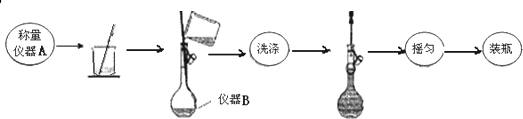

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 4.8g滤渣是由3.2g铜和1.6g铁组成 | B. | ω=14.7 | ||
| C. | 反应过程中产生的氢气是2.24L | D. | 滤液是20.88%的硫酸亚铁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com