
科目: 来源: 题型:选择题
| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪烃) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠与水反应生成2.24 L O2时转移的电子数为0.2NA | |
| B. | 1 L 14 mol/L硝酸与足量铜反应生成气体分子数小于7NA | |
| C. | 1 L1 mol/L NaHS溶液中H2S、HS-和S2-粒子数之和为NA | |
| D. | 1 mol OH-的电子总数比1 mol-OH的电子总数多NA |
查看答案和解析>>
科目: 来源: 题型:解答题
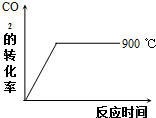 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
查看答案和解析>>
科目: 来源: 题型:解答题
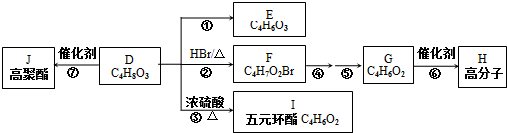
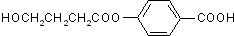 、I
、I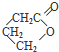 、J
、J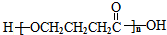 .
. .
. .
.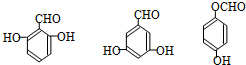 任意一种.
任意一种.查看答案和解析>>
科目: 来源: 题型:解答题
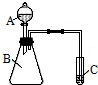 下表中实线表示目前元素周期表七个周期的部分边界. ①~⑧八种元素在周期表中的相对位置如下:
下表中实线表示目前元素周期表七个周期的部分边界. ①~⑧八种元素在周期表中的相对位置如下:
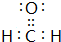 .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | M是阴离子交换膜 | B. | Y电极上产生无色气体 | ||
| C. | X电极区域可产生Mg(OH)2 | D. | X电极反应式为4OH--4e-═O2↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
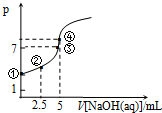 常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )| A. | 水电离出的c(OH-):①点小于 ③点 | |
| B. | 此反应的滴定实验宜选用甲基橙做指示剂 | |
| C. | ②点时c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-) | |
| D. | ④点时c(Na+)=c(N3-)+c(HN3)=$\frac{1}{15}$mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锅炉水垢用饱和纯碱溶液浸泡,即可除去 | |
| B. | 向淀粉水解后的溶液中滴加碘水,即可检验淀粉是否水解完全 | |
| C. | 向C2H5X消去反应后的溶液中滴加硝酸银溶液,即可检验卤原子X的种类 | |
| D. | 将25 g CuSO4•5H2O溶于100 mL水中,可配得100 mL1.0 mol/L CuSO4溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚乙烯食品袋耐高温加热 | |
| B. | 石英玻璃仪器耐酸碱腐蚀 | |
| C. | 羊毛织物可用强碱性洗涤剂清洗 | |
| D. | 把铅加入锡中制造焊锡的目的是降低熔点 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com