
科目: 来源: 题型:选择题
| A. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| B. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
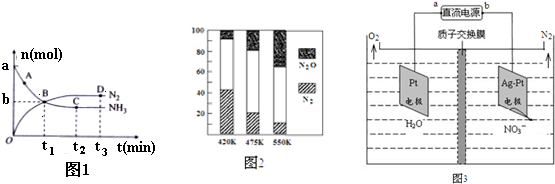
查看答案和解析>>
科目: 来源: 题型:解答题

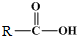 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$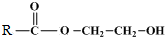
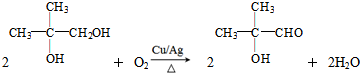 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
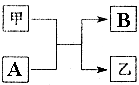 单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:
单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

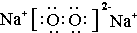
查看答案和解析>>
科目: 来源: 题型:选择题
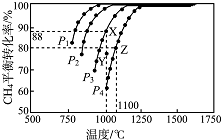 现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )
现向一密闭容器中充入物质的量浓度均为0.10mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)═2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示.下列说法不正确的是( )| A. | △H>0 | |
| B. | P4>P3>P2>Pl | |
| C. | 1000℃,P3条件下,在Y点:v(正)<v(逆) | |
| D. | 1100℃,P4条件下,该反应的平衡常数K=l.64 (mol/L)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
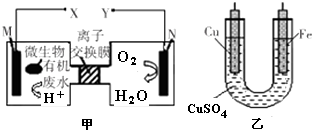
| A. | 铜电极应与X相连接 | |
| B. | H+透过离子交换膜由N极向M极移动 | |
| C. | M电极反应式:(C6H10O5)n+7n H2O-24n e-═6n CO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 与漂白粉溶液反应的离子方程式:Ca2++SO32-=CaSO3↓ | |
| B. | 通入HCl至溶液pH=7:c(Na+)=2c(SO32-)+c(HSO3-)+c(Cl-) | |
| C. | 加入NaOH固体可使溶液中水的电离程度增大 | |
| D. | 通入SO2至过量:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同周期金属元素的化合价越高,元素的金属性越强 | |
| B. | 海轮外壳上附着一些锌块,可以减缓海轮外壳的腐蚀 | |
| C. | 在含有 BaSO4 沉淀的溶液中加入 Na2SO4固体,c(Ba2+) 增大 | |
| D. | 2NO(g)+2CO(g)═N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸馏实验时向蒸馏烧瓶中放入几粒沸石(或碎瓷片) | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 用试管加热碳酸氢钠固体时使试管口略向上倾斜 | |
| D. | 浓硫酸溅到皮肤上立即用稀氢氧化钠溶液冲洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com