
科目: 来源: 题型:选择题
| A. | CH3COONa溶液中加入少量KCl固体后的碱性溶液一定有:c(Na+)-c(CH3COO-)=c(OH-)-c(H+) | |
| B. | 同浓度的CH3COONa和NaClO混合液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL(忽略溶液体积变化) | |
| D. | 某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后恰好完全反应,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05 mol•L-1(忽略溶液体积变化) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗 | |
| B. | 银氨溶液、Cu(OH)2悬浊液、氯水在实验室里均不宜长期放置 | |
| C. | 检验C2H5Cl中的氯元素:将C2H5Cl与NaOH溶液混合加热,冷却后加AgNO3溶液 | |
| D. | 同温下用pH试纸测定等浓度的NaClO溶液和CH3COONa溶液的pH,可以证明HClO和CH3COOH的酸性强弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能使石蕊溶液呈红色的溶液中:Na+、SO42-、Fe3+、MnO4-可以大量共存 | |
| B. | NA代表阿伏加德罗常数的数值,1 mol硫酸氢钾晶体中阳离子所带电荷总数为NA | |
| C. | 235U与238U的相互转化不是化学变化 | |
| D. | 元素O、S、P的气态氢化物热稳定性依次增强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 长期饮用纯净水,有可能引起一些微量元素缺乏症 | |
| B. | 明矾既能沉降水中的悬浮物,又能杀菌消毒 | |
| C. | 合成洗涤剂和纯碱溶液都可洗去油污,二者去污原理相同 | |
| D. | 纤维素被食用进入人体内,在酶的作用下最终水解为葡萄糖为人体提供能量 |
查看答案和解析>>
科目: 来源: 题型:解答题
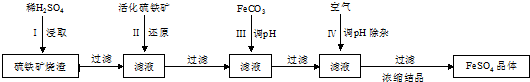
查看答案和解析>>
科目: 来源: 题型:解答题
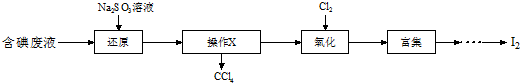

查看答案和解析>>
科目: 来源: 题型:解答题
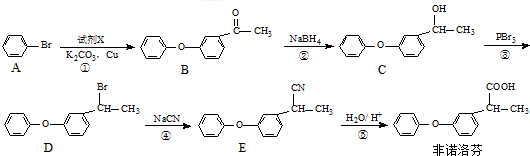
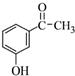 .
. .
. .
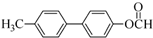
.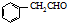 为原料制备
为原料制备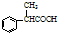 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 90 g丙醇中存在的共价键总数为15 NA | |
| B. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.2 NA | |
| D. | 2 L 0.5 mol/L亚硫酸溶液中含有的H+离子数为2 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| B. | $\frac{{k}_{W}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:NH4+、Na+、SiO32-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com