
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
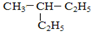 和
和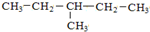
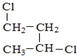 与
与 ④H2O和D2O
④H2O和D2O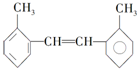 其苯环上的一氯代物有4种;1mol该物质和溴水混合,消耗Br2的物质的量为1mol.
其苯环上的一氯代物有4种;1mol该物质和溴水混合,消耗Br2的物质的量为1mol.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
| 序号 | CaCO3/mol | CaO/mol | CO2/mol |
| A | 0.02 | 0.02 | 0.05 |
| B | 0.02 | 0.02 | 0.03 |
| C | 0.02 | 0.02 | 0.01 |
| D | 0.02 | 0 | 0.05 |
| E | 0.02 | 0.02 | 0 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
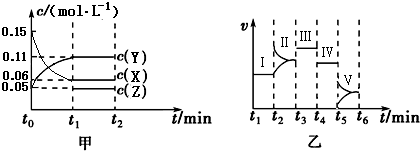
 2Y(g)+Z(g)△H=-10akJ/mol.在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是Ⅴ.
2Y(g)+Z(g)△H=-10akJ/mol.在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是Ⅴ.查看答案和解析>>
科目: 来源: 题型:解答题
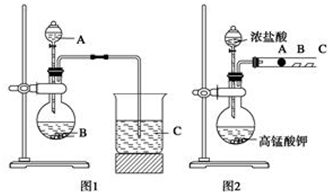
查看答案和解析>>
科目: 来源: 题型:解答题
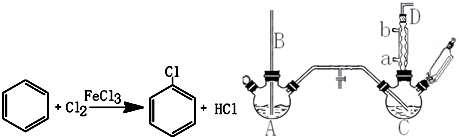
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
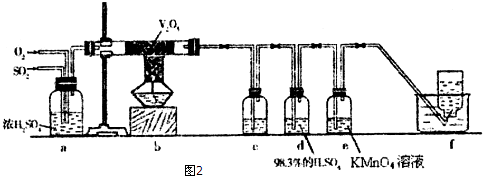
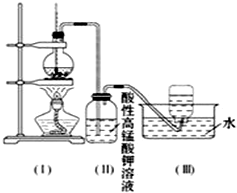 如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O.
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯,加热一段时间后溶液中有黑色现象出现.过一段时间后,经硫酸酸化的高锰酸钾溶液褪色.经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com