
科目: 来源: 题型:选择题
| A. | 0.02 mol•L-1醋酸与0.02 mol•L-1NaOH等体积混合后的溶液中加少量的CH3COONa固体则$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大 | |
| B. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | lmol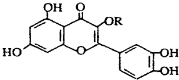 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol 与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | 红外光谱分析不能区分乙醇和乙醚 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
. ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.| X射线衍射 | N-H键长 | N-N距离 | H-N-H键角 |
| 数据 | 101.9pm | 339.0pm | 107° |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2++2NH3•H2O═Fe(OH)2↓+2NH4+ | |
| B. | Fe2++NH3•H2O+HCO3-═FeCO3↓+NH4++H20 | |
| C. | Fe2++2HCO3-═Fe(OH)2↓+2CO2↑ | |
| D. | 2Fe2++HCO3-+3NH3•H2O═Fe2(OH)2CO3↓+3NH4++H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中;2n(H2A)+n(A2-)=0.002mol | |
| B. | b点所得溶液中:c(H2A)+c(H+)=c(A2-)+e(OH-) | |
| C. | C点所得溶液中:c(Na+)<3c(HA-) | |
| D. | d点所得溶液中:c(Na+)>c(A2-)>c(HA-) |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
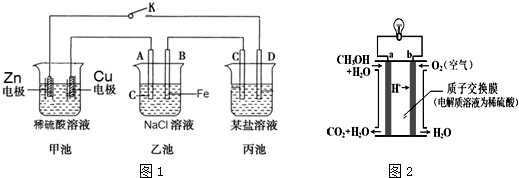
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
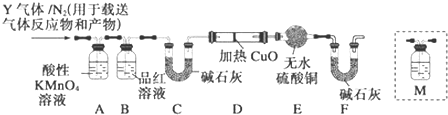
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com