
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl- | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)工业上用无水硫酸钠生产硫化钠的流程如下:
(1)工业上用无水硫酸钠生产硫化钠的流程如下:查看答案和解析>>
科目: 来源: 题型:解答题
 )分子的一氯代物有2种.
)分子的一氯代物有2种.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.时间/h 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 |
| 950℃ | 0.669 | 0.711 | 0.713 | 0.714 | 0.714 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫化钠加入水中S2-+2H2O═H2S+2OH- | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应2Fe+3H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
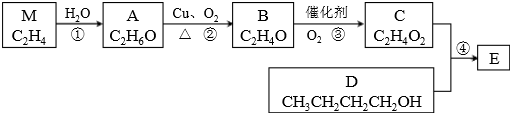
查看答案和解析>>
科目: 来源: 题型:实验题
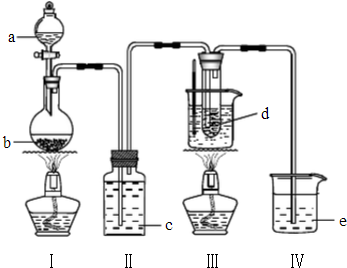 氯气与碱溶液反应时,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO-和Cl-.研究小组用以下实验装置制取氯酸钾(KClO3)并测定溶度.
氯气与碱溶液反应时,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO-和Cl-.研究小组用以下实验装置制取氯酸钾(KClO3)并测定溶度.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com