
科目: 来源: 题型:解答题
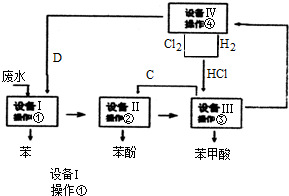
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,正反应速率等于逆反应速率 | |
| D. | t3后,若升高温度则反应速率不一定增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加热饱和三氯化铁溶液制备氢氧化铁胶体:Fe3++3H2O$\stackrel{△}{?}$Fe(OH)3(胶体)+3H+ | |
| B. | 硫氢根离子的电离方程式:HS-+H2O?H3O++S2- | |
| C. | 少量氢氧化钙溶液与碳酸氢钠溶液混合的离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 0.5mol•L-1的K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+,其平衡常数K的表达式为K=$\frac{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{{O}_{7}}^{2-})}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 元素代号 | A | B | C | D | E | F | G | H |
| 原子半径/pm | 37 | 160 | 70 | 66 | 186 | 143 | 104 | 99 |
| 最高化合价 | +1 | +2 | +5 | +1 | +3 | +6 | +7 | |
| 最低化合价 | -3 | -2 | -2 | -1 |
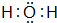 ,B、H两种元素形成化合物的电子式是
,B、H两种元素形成化合物的电子式是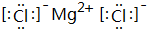 ;
;查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com