
科目: 来源: 题型:实验题
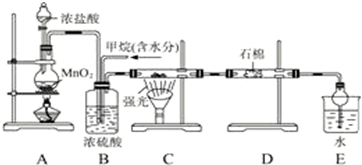
查看答案和解析>>
科目: 来源: 题型:解答题
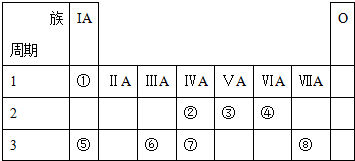
查看答案和解析>>
科目: 来源: 题型:选择题
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 6mol/L盐酸 | 10mL | 30℃ |
| B | Mg | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| D | Mg | 0.1 | 6mol/L盐酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
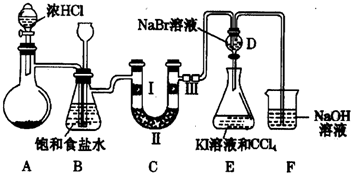
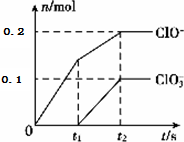
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 和
和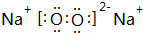 ;
; ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60s内以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的正反应为吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10s-15sC(NH3)增加量等于0.25 mol/L | |
| B. | 化学反应速率的关系是3v正(H2)=2v正(NH3) | |
| C. | 达到平衡后,分离出少量NH3,平衡正向移动,v正增大 | |
| D. | 保持压强不变充入Ar气体,v正减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com