
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
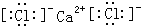 .
.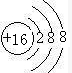 ;D与E能形成一种类似与CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的结构式为S=C=S;化学键类型为极性共价键.
;D与E能形成一种类似与CO2的三原子分子,且每个原子均达到了8电子稳定结构,该分子的结构式为S=C=S;化学键类型为极性共价键.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
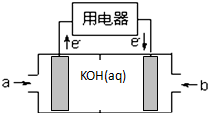 现有部分短周期元素的性质或原子结构如表:
现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| A | 原子序数最小的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最外层电子数比次外层电子数多3 |
| D | 单质的一种同素异形体是保护地球地表环境的重要屏障 |
| E | 最高正化合价为+7 |
| F | 第3周期元素原子半径 最大 |
 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
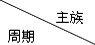 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应的热化学方程式为2NH4Cl+Ba(OH)2═BaCl2+2NH3•H2O;△H>0 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 氯化铵与氢氧化钡的反应为放热反应 | |
| D. | 该反应中,化学能全部转化为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com