
科目: 来源: 题型:解答题
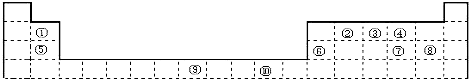
查看答案和解析>>
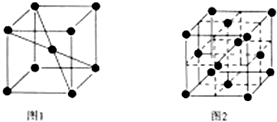
科目: 来源: 题型:解答题
查看答案和解析>>
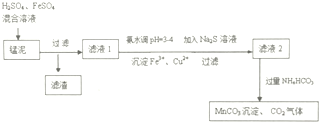
科目: 来源: 题型:解答题
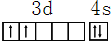 ,其原子核外共有22种运动状态不相同的电子.
,其原子核外共有22种运动状态不相同的电子.查看答案和解析>>
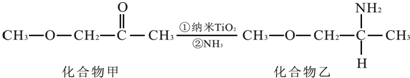
科目: 来源: 题型:多选题
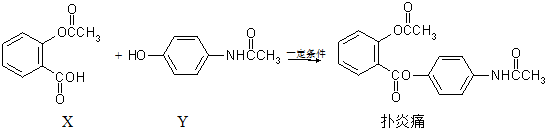
| A. | 扑炎痛的分子式为C17H16NO5 | |
| B. | 可用FeCl3溶液检验扑炎痛中是否含有化合物Y | |
| C. | 扑炎痛在酸性条件下水解最终可以得到3种物质 | |
| D. | 1 mol扑炎痛与足量的NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
科目: 来源: 题型:解答题
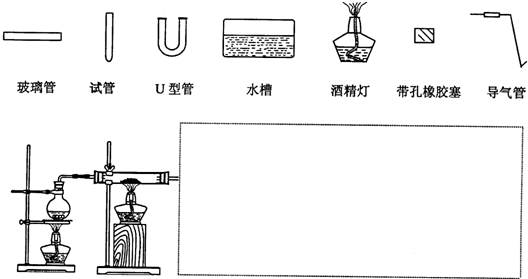
查看答案和解析>>
科目: 来源: 题型:解答题
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
查看答案和解析>>
科目: 来源: 题型:选择题
 )是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )
)是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )| A. | 化学式为C5H9NO4Na | |
| B. | 味精难溶于水 | |
| C. | 只能和盐酸反应,不能和氢氧化钠溶液反应 | |
| D. | 炒菜时味精不宜早放 |
查看答案和解析>>
科目: 来源: 题型:解答题
 乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.查看答案和解析>>
科目: 来源: 题型:选择题
| AgCl | Ag2CrO4 | Ag2S | AgBr | AgI | |
| 颜色 | 白色 | 橘红色 | 黑色 | 淡黄色 | 黄色 |
| Ksp | 1.8×10-10 | 1.1×10-12 | 6.0×10-50 | 7.7×10-13 | 8.5×10-16 |
| A. | 往Ag2S悬浊液中加入少量K2CrO4溶液,沉淀将由黑色变成橘红色 | |
| B. | 反应2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=5.4×1029 | |
| C. | 用AgNO3标准溶液测定溶液中的c(Cl-),可用K2CrO4或K2S溶液作指示剂 | |
| D. | 在20mL浓度均为1.8×10-6mol•L-1的Cl-、Br-及I-的混合溶液中,逐滴(1滴约0.05mL)加入0.01mol•L-1的AgNO3溶液,可依次得到AgCl、AgBr和AgI沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| B. | 加强碱溶液后加热,滴入酚酞试液,观察溶液颜色 | |
| C. | 加热,将湿润的红色石蕊试纸放在管口观察现象 | |
| D. | 加苛性钠溶液后加热,用湿润的红色石蕊试纸放在试管口进行检验 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com