
科目: 来源: 题型:选择题
| A. | 0.1 mol Na2O2中所含的阴离子数为0.2NA | |
| B. | 常温常压下,5.6 g N2和CO混合物中所含有的原子总数为0.4 NA | |
| C. | 标准状况下,2.24 L H2O中含有的氧原子数目为0.1 NA | |
| D. | Cu和足量的浓硫酸反应产生4.48 L气体时,转移的电子数为0.4 NA |
查看答案和解析>>
科目: 来源: 题型:解答题
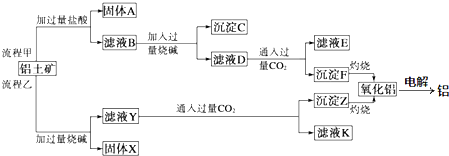
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Ba2+ | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、HCO3-、Ca2+、Na+ | D. | Ba2+、Na+、OH-、NO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
 铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.
铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀.已知铬在自然界最重要的矿物是铬铁矿[Fe(CrO2)2或FeO.Cr2O3],工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程.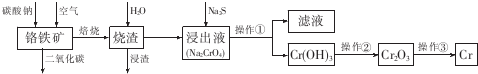
查看答案和解析>>
科目: 来源: 题型:解答题
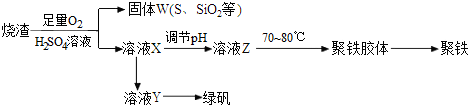

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能够完全电离的电解质称为强电解质,如硫酸、盐酸、氢氧化钠等是强电解质 | |
| B. | 1mol甲烷燃烧放出的热量为CH4的燃烧热 | |
| C. | 中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 | |
| D. | 风能是正在探索的新能源之一,它是太阳能的一种转换形式,具有不稳定 |
查看答案和解析>>
科目: 来源: 题型:填空题
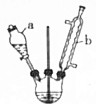 己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下:
己二酸是合成高分子化合物尼龙-66的原料.某学习小组拟在实验室以环己醇为原料制备己二酸.反应原理如下: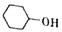 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH3)4COOH+8NO↑+7H2O查看答案和解析>>
科目: 来源: 题型:实验题
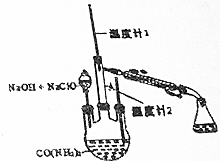 水合肼(N2H4•H2O)常用作还原剂和抗氧剂,其熔点为-40℃,沸点118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H20)涉及下列反应:
水合肼(N2H4•H2O)常用作还原剂和抗氧剂,其熔点为-40℃,沸点118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H20)涉及下列反应:查看答案和解析>>
科目: 来源: 题型:解答题
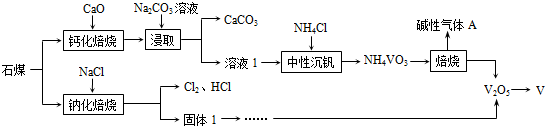
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com