
科目: 来源: 题型:解答题
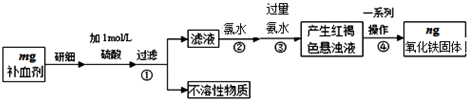
查看答案和解析>>
科目: 来源: 题型:解答题
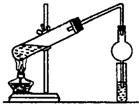
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目: 来源: 题型:解答题
 某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.
某同学用乙醇、乙酸和浓硫酸制取乙酸乙酯,装置如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将a molL-1 HCN溶液与a molL-1 NaOH溶液等体积混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴定终点读数时俯视读数 | |
| B. | 锥形瓶洗净后未干燥 | |
| C. | 碱式滴定管滴定前尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 酸式滴定管使用前,水洗后未用待测盐酸润洗 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
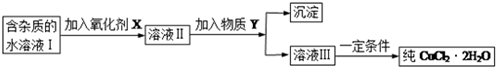
查看答案和解析>>
科目: 来源: 题型:解答题
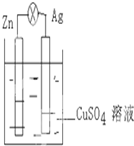 如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.
如图,在银锌原电池中,以硫酸铜溶液为电解质溶液.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com