
科目: 来源: 题型:选择题
| A. | CH3CH(CH3)2 | B. | CH3CH2CH2CH3 | C. | (CH3)2CHCH2CH3 | D. | CH3C(CH3)3 |
查看答案和解析>>
科目: 来源: 题型:解答题
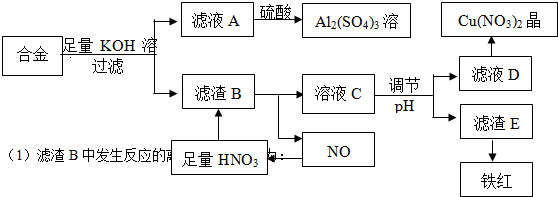
查看答案和解析>>
科目: 来源: 题型:解答题
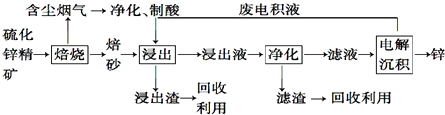
查看答案和解析>>
科目: 来源: 题型:解答题
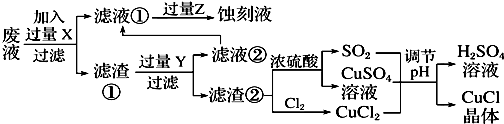
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ⑤③④① |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
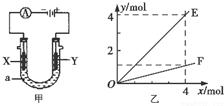
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com