
科目: 来源: 题型:填空题
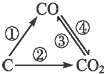 随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).
随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).查看答案和解析>>
科目: 来源: 题型:填空题
 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 阳离子核外无电子 |
| B | 最高正价和最低负价的绝对值之差为2 |
| C | 最外层电子数是内层电子数的3倍 |
| D | 1molD单质能与冷水反应,在标准状况下生成11.2LH2 |
| E | 原子最外层电子数等于其周期序数 |
| F | 负二价阴离子的电子层结构与Ar原子相同 |
 ;
;查看答案和解析>>
科目: 来源: 题型:填空题
 ;
;查看答案和解析>>
科目: 来源: 题型:解答题
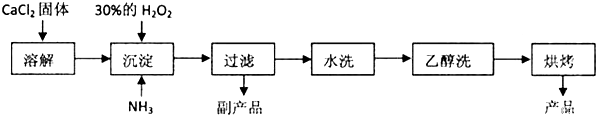
查看答案和解析>>
科目: 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
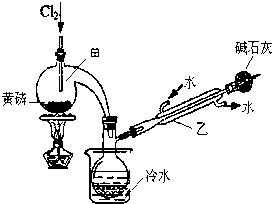
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com