
科目: 来源: 题型:选择题
| A. | 气态氢化物稳定性:HF>HCl | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>Cl | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
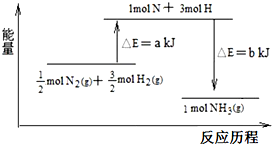
查看答案和解析>>
科目: 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | c | d | e | f | g | |
| 3 | b | h | i | j | k |
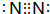 ,e的氢化物的结构式为
,e的氢化物的结构式为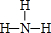 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
 据图回答下列问题:
据图回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 干冰升华时要吸收热量,所以这是吸热反应 | |
| B. | 化学反应中能量的变化都表现为热量的变化 | |
| C. | 1 mol Ba(OH)2与1 mol H2SO4反应释放的热量为Q,则Q为它们反 应的中和热 | |
| D. | 物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能 释放出来 |
查看答案和解析>>
科目: 来源: 题型:解答题
| X | Y | |
| Z | W | |
| T |
 (写电子式);
(写电子式);查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
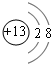 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com