
科目: 来源: 题型:选择题
| A. | Z为0.3 mol•L-1 | B. | Y2为0.1 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
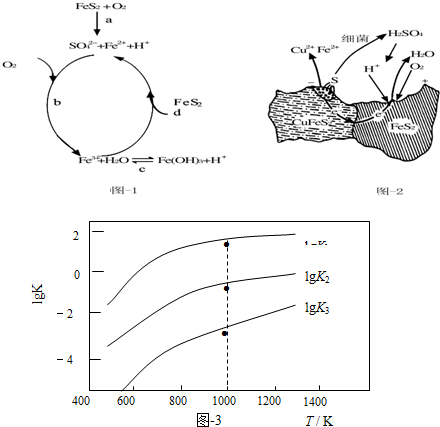
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目: 来源: 题型:解答题
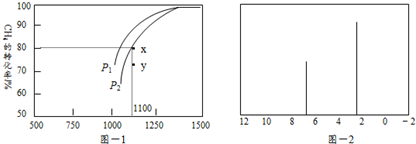
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 铅蓄电池放电时,正极和负极的电极质量均增大 | |
| B. | 反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H<0 | |
| C. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 | |
| D. | C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol溴苯中含有双键的数目为0.3NA | |
| B. | 1L 0.1 mol/L醋酸溶液中含有醋酸分子的数目为0.1 NA | |
| C. | 常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | 常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:解答题
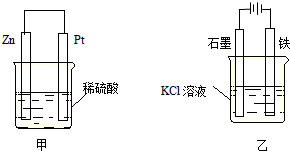
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com