
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用量筒测得排水法收集制得的氢气体积为5.28 mL | |
| B. | 用两只250 mL的容量瓶配制0.1mol/L 500 mL的NaOH溶液 | |
| C. | 用托盘天平称得2.50g胆矾,受热充分失水后,固体质量减轻0.90g | |
| D. | 常温下,测得1molN2的质量为28g |
查看答案和解析>>
科目: 来源: 题型:选择题
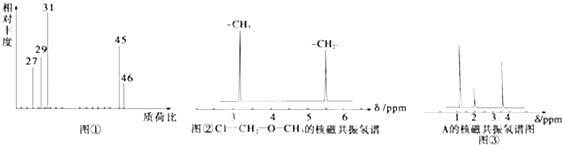
| A. | 由核磁共振氢谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由红外光谱可知,该有机物分子中有三种不同的氢原子 | |
| C. | 若A的化学式为C2H6O,则其结构简式为CH3-O-CH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |

查看答案和解析>>
科目: 来源: 题型:解答题
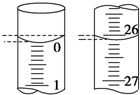 氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.
氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之).现用0.1000mol•L-1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO${\;}_{4}^{-}$+5H2C2O4+6H+═2Mn2++CO2↑+8H2O.| 滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol•L-1 KMnO4的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 2 8.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 来源: 题型:解答题
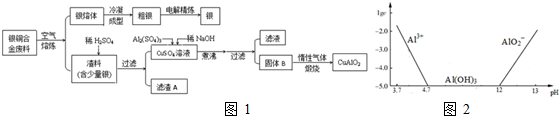
查看答案和解析>>
科目: 来源: 题型:填空题
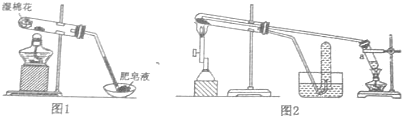
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到的黑色固体X,取出少量放人另一试管中,加人少量盐酸,微热 | 黑色粉末逐渐溶解,产生少量气泡 |
| Ⅱ | 向上述实验得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液未出现红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com