
科目: 来源: 题型:解答题

| 物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | NaCl |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 801 |
查看答案和解析>>
科目: 来源: 题型:解答题
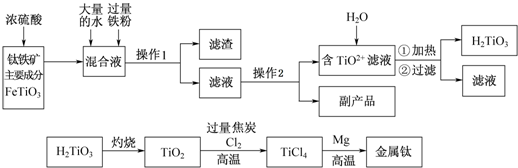
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 装置 | 实验前的质量/g | 实验后的质量/g |
| F | 22.5 | 33.6 |
| H | 42.4 | 51.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
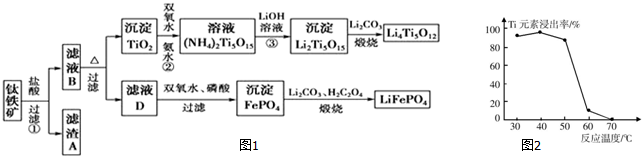
查看答案和解析>>
科目: 来源: 题型:填空题
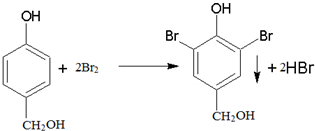 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

 .
.查看答案和解析>>
科目: 来源: 题型:填空题
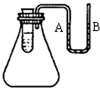
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com