
科目: 来源: 题型:选择题
| A. | C17H19NO3 | B. | C17H21NO4 | C. | C17H25NO3 | D. | C25H27NO7 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
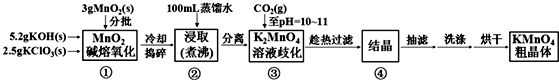
查看答案和解析>>
科目: 来源: 题型:选择题
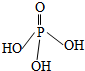 三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )
三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两个水分子的产物,三聚磷酸钠(俗称“五钠”)是常用的水处理剂.下列说法错误的是( )| A. | 三聚磷酸中P的化合价为+5 | |
| B. | 三聚磷酸钠的化学式为Na3P3O10 | |
| C. | 按上述原理,四聚磷酸的化学式为H6P4O13 | |
| D. | 多聚磷酸的结构可表示为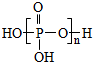 |
查看答案和解析>>
科目: 来源: 题型:解答题
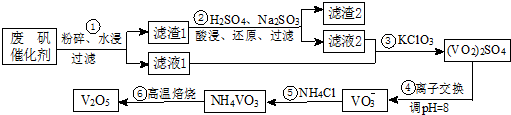
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
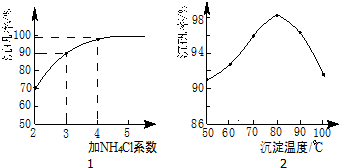
查看答案和解析>>
科目: 来源: 题型:解答题
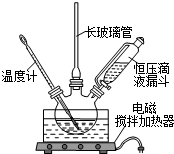 硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
硝基苯是医药和染料的中间体,还可做有机溶剂.反应如下:
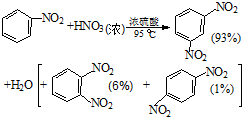
| 物质 | 熔点/ ℃ | 沸点 /℃ | 密度(20℃) /g•cm-3 | 水溶性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶 |
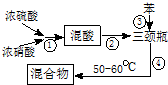

查看答案和解析>>
科目: 来源: 题型:解答题
 ;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.
;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式6Li+N2=2Li3N.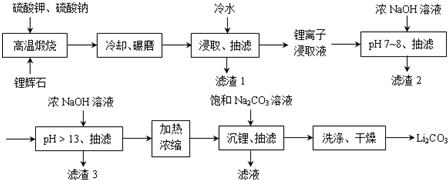
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
查看答案和解析>>
科目: 来源: 题型:解答题
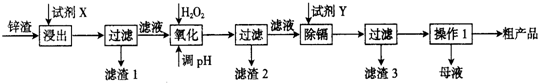
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
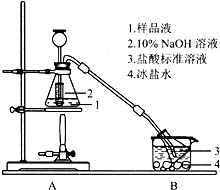 Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.
Cux(NH3)y(SO4)z•nH2O是深蓝色晶体,可溶于水,不溶于乙醇、乙醚等有机溶剂,常用作杀虫剂、媒染剂等.某小组利用废铜屑、硫酸、氨水等原料制备该晶体并测定其组成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com