
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 每个53131Cs含有78个中子 | B. | CsOH的碱性比KOH的强 | ||
| C. | HI的还原性比HF的强 | D. | KIO3是碘的最高价含氧酸的盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100g氨水中含10gNH3•H2O | B. | 10gNH3溶于水形成100g溶液 | ||
| C. | 100g氨水中含10gNH3 | D. | 10gNH3溶于100gH2O形成的溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题

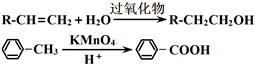

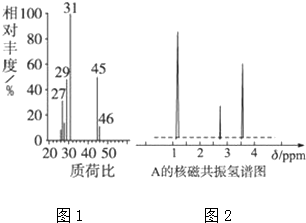
查看答案和解析>>
科目: 来源: 题型:解答题
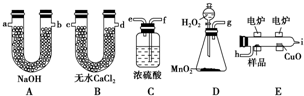
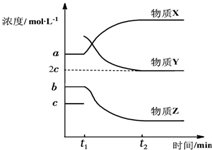
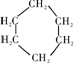 .若该有机物M能使溴水褪色,且所有碳原子共面,则M的结构简式为(CH3)2C=C(CH3)2.
.若该有机物M能使溴水褪色,且所有碳原子共面,则M的结构简式为(CH3)2C=C(CH3)2.查看答案和解析>>
科目: 来源: 题型:解答题
 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: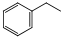 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$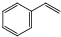 (g)+H2(g)△H=+120kJ•mol-1
(g)+H2(g)△H=+120kJ•mol-1查看答案和解析>>
科目: 来源: 题型:解答题
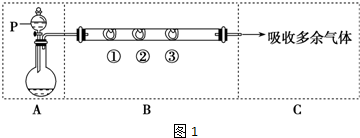
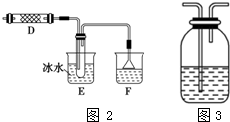
查看答案和解析>>
科目: 来源: 题型:解答题
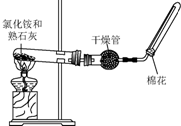 A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C、D是中学化学常见的四种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| B. | 金属与浓硫酸或浓硝酸反应都不会产生氢气 | |
| C. | 每1 molCu参加反应就有2 mol浓 H2SO4被还原,同时生成2 mol SO2 | |
| D. | 浓硫酸因为有吸水性,可用来干燥HCl、SO2、Cl2等多种气体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com