
科目: 来源: 题型:选择题
| A. | 分子通式为CnH2n+2的两烷烃一定互为同系物 | |
| B. | 卤代烃发生水解反应一定生成醇 | |
| C. | 苯和甲苯都能被酸性KMnO4溶液氧化 | |
| D. | 烃类都能燃烧生成CO2和水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| B. | 1 mol甲苯能与3 mol H2发生加成反应 | |
| C. | 甲苯能使酸性高锰酸钾褪色 | |
| D. | 甲苯能燃烧产生带浓烟的火焰 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙烯的结构简式可表示为CH2CH2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 甲烷的结构式:CH4 | D. | 甲苯的键线式可表示为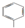 |
查看答案和解析>>
科目: 来源: 题型:选择题
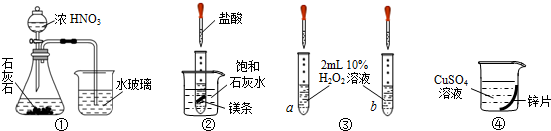
| A. | 实验①烧杯中出现白色胶状沉淀,证明非金属性:N>C>Si | |
| B. | 实验②烧杯中出现白色浑浊,说明镁与盐酸反应是放热反应 | |
| C. | 实验③a、b分别滴加2滴FeCl3溶液、CuSO4溶液,验证不同催化剂对反应速率的影响 | |
| D. | 实验④利用置换反应,证明金属单质还原性强弱,判断金属性强弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 其最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物溶于水,水溶液一定显酸性 | D. | 其最高价氧化物对应水化物为强碱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{m(M-n)}{M}$ | B. | $\frac{M-n+2}{Mm}$ | C. | $\frac{m(M-n+2)}{M}$ | D. | $\frac{m(M-n-2)}{M}$ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol | |
| B. | 若P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol,则红磷比白磷稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目: 来源: 题型:解答题
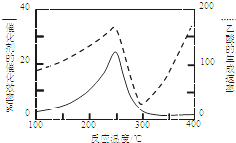 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com