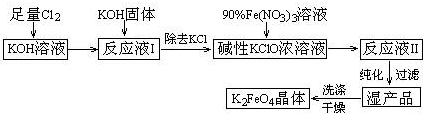
8.高铁酸钾(K
2FeO
4)是一种集强氧化性、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:
已知K
2FeO
4具有下列性质:
①可溶于水、微溶于浓KOH溶液
②在0℃~5℃、强碱性溶液中比较稳定
③在Fe
3+和Fe(OH)
3催化作用下发生分解
④在酸性至弱碱性条件下,能与水反应生成Fe(OH)
3和O
2请完成下列填空:
(1)已知Cl
2与KOH在较高温度下反应生成的是KClO
3.在不改变KOH溶液的浓度和体积的条件下,生产KClO应在温度较低的情况下进行(填“较高”或“较低”);
(2)生产K
2FeO
4的反应原理是:Fe(NO
3)
3+KaClO+KOH→K
2FeO
4+KNO
3+KCl+H
2O(未配平) 则该反应中氧化剂与还原剂的物质的量之比为3:2;
(3)K
2FeO
4在弱碱性条件下能与水反应生成Fe(OH)
3和O
2,则该反应的化学方程式为:4K
2FeO
4+10H
2O=8KOH+4Fe(OH)
3↓+3O
2↑.
(4)在“反应液I”中加KOH固体的目的是AB.
A.为下一步反应提供反应物
B.与“反应液I”中过量的Cl
2继续反应,生成更多的KClO
C.KOH固体溶解时会放出较多的热量,有利于提高反应速率
D.使副产物KClO
3转化为KCl
(5)制备K
2FeO
4时,须将90%的Fe(NO
3)
3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌.采用这种混合方式的原因是减少K
2FeO
4在过量Fe
3+作用下的分解(或K
2FeO
4在低温、强碱性溶液中比较稳定等)(答出1条即可).
(6)从“反应液Ⅱ”中分离出K
2FeO
4晶体后,可以得到的副产品有KNO
3、KCl(写化学式).
(7)工业上常用“间接碘量法”测定高铁酸钾样品中高铁酸钾的含量,其方法是:用碱性的碘化钾溶液(pH为11~12)溶解3.96g高铁酸钾样品,调节pH为1,避光放置40分钟至反应完全(高铁酸根离子全部被还原成铁离子),再调节pH为3~4(弱酸性),用1.0mol/L的硫代硫酸钠标准溶液作为滴定剂进行滴定(2Na
2S
2O
3+I
2═Na
2S
4O
6+2NaI),当达到滴定终点时,用去硫代硫酸钠标准溶液15.00mL.则原高铁酸钾样品中高铁酸钾的质量分数为25%.


