
科目: 来源: 题型:解答题
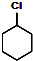 $→_{②}^{NaOH,乙醇,△}$
$→_{②}^{NaOH,乙醇,△}$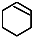 $→_{③}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{Br_{2}的CCl_{4}溶液}$B$\stackrel{④}{→}$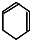
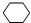 ,B的结构简式是
,B的结构简式是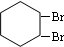 ;
; .
.查看答案和解析>>
科目: 来源: 题型:选择题
 在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )| A. | ①加CCl4 ②加苯 ③加酒精 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$ a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$ a mol≤ne≤$\frac{5}{6}$ a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$a mol |
查看答案和解析>>
科目: 来源: 题型:选择题
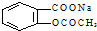 转变为
转变为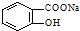 的方法为( )
的方法为( )| A. | 与足量的NaOH溶液共热后,再通入CO2 | |
| B. | 与氢氧化钠溶液热,通入足量的HCl | |
| C. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
查看答案和解析>>
科目: 来源: 题型:解答题
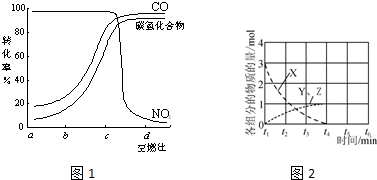
查看答案和解析>>
科目: 来源: 题型:解答题
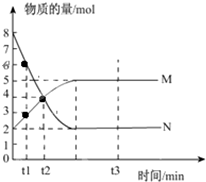 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
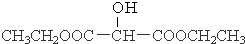 .
.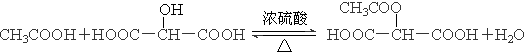 .
.
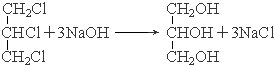 .
.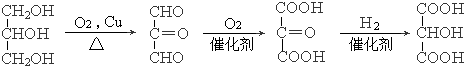 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应属于分解反应、放热反应 | |
| B. | 该反应瞬间能产生大量高温气体,推动飞船飞行 | |
| C. | 该反应把化学能转变为热能和动能 | |
| D. | 该反应反应物的总能量小于生成物的总能量 |
查看答案和解析>>
科目: 来源: 题型:解答题
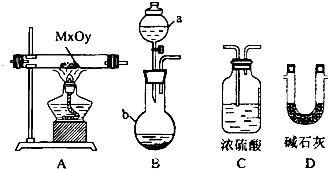
| 序号 | 固体成分(填化学式) |
| 1 | |
| 2 | |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com