
科目: 来源: 题型:解答题
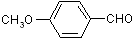 )具有多种同分异构体.
)具有多种同分异构体.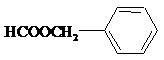 ;②
;②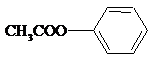 ;③
;③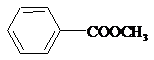 ;
;查看答案和解析>>
科目: 来源: 题型:填空题

 .
.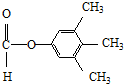 、
、 .
.查看答案和解析>>
科目: 来源: 题型:填空题
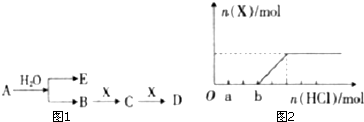
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| C. | 同主族两种元素原子的核外电子数的差值可能为26 | |
| D. | 科学家在周期表中金属元素与非金属元素分界线处找到了优良的催化剂 |
查看答案和解析>>
科目: 来源: 题型:实验题
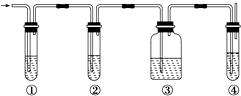 有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2.
有人设计了如图所示实验,以确认某混合气体中含有C2H4和SO2.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c1:c2的值不能确定 | |
| B. | 平衡时,Y和Z的生成速率之比为1:1 | |
| C. | 0.48mol•L-1<c1+c2+c3<0.56mol•L-1 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com