
科目: 来源: 题型:选择题
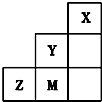
| A. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 | |
| B. | 离子半径:M->Z2->Y- | |
| C. | 稳定性:HY<HM | |
| D. | 非金属性:Y>M>Z |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同一周期原子半径从左到右依次减小 | |
| B. | 同一主族元素的化学性质相同 | |
| C. | 同一周期元素最高化合价从左到右不一定增大 | |
| D. | 同一主族元素的化学性质相似 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴 1mol/LFeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增多. |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2 溶液 | 两支试管中均未明显见到有 气泡产生. |
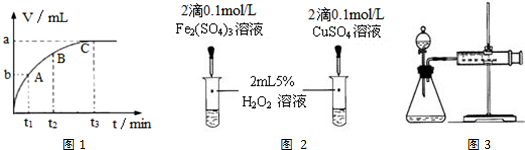
查看答案和解析>>
科目: 来源: 题型:解答题
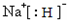 ,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.
,D与E形成的化合物可作潜水面具中的供氧剂,则该化合物与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.8gNa2O2固体中含离子总数为0.4NA | |
| B. | 2.0gH218O和D216O的混合物中所含中子数为NA | |
| C. | 常温下,22.4LCH4中含C-H共价键数为4NA | |
| D. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 表中最稳定的共价键是H-F | B. | H2(g)=2H(g)需吸收436kJ的能量 | ||
| C. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | D. | 反应H2(g)+F2(g)=2HF(g)放出25kJ的能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将碳块磨成粉末可加快反应速率 | |
| B. | 增加碳的质量可加快反应速率 | |
| C. | 升高温度可加快反应速率 | |
| D. | 容器体积不变时,向容器中充入氦气,反应速率不变 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 次氯酸的结构式:H-Cl-O | B. | 16O2-和18O2-的结构示意图: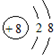 | ||
| C. | 氮气的电子式: | D. | 电子式表示氯化钠的形成过程: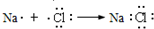 |
查看答案和解析>>
科目: 来源: 题型:解答题
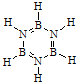 ,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:
,通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得.A在一定条件下通过多步去氢可最终转化为氮化硼(BN).请回答:| 化学键 | B-H | B-O | B-B |
| 键能(KJ•mol-1) | 389 | 561 | 293 |
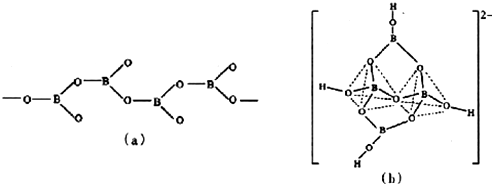
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com