
科目: 来源: 题型:选择题
| A. | (2)(4)(5) | B. | (2)(7) | C. | (1)(3)(4) | D. | (5)(6)(7) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
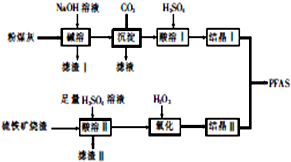 聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:查看答案和解析>>
科目: 来源: 题型:解答题
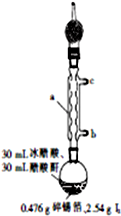 四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
四碘化锡(SnI4)是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,
用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如表所示,| 实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
| 1 | 25.00 | 24.41 |
| 2 | 25.00 | 24.39 |
| 3 | 25.00 | 24.60 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com